產業投行:新藥火熱的今天,回顧史上最大醫學災難
科學的探索,從來都不是一帆風順,而是螺旋式上升。成功往往是建立在多次失敗的肩膀上,有時候還要加上一點點運氣。
醫學上的發現尤其如此,無論是盤尼西林、偉哥的發現,還是本文的沙利度胺,都上演了“山窮水盡疑無路,柳暗花明又一村”的故事。
沙利度胺本身會導致“海豹胎”(胎兒發育畸形),但是將沙利度胺稍微改造一下,去掉一個羧基,加上一個氨基,就成了治療骨髓瘤和淋巴瘤的神藥來那度胺。2017年,來那度胺的銷售額達82億美元。
最近,大家寄予厚望的幾個臨床三期的阿爾茲海默試驗都失敗了。然而,正是這些失敗又讓人們重新開始審視阿爾茲海默的發病機理,我們有理由相信,未來有一天,我們在攻克阿爾茲海默這個堡壘上一定會取得突破。
在科學面前,唯有尊重數據。如果我們為了利益企圖掩蓋事實真相,只會像沙利度胺那樣,上演人間悲劇。正視失敗,分析其后的原因,成功遲早到來。
“沙利度胺(反應停)事件”是現代醫學史上最大的災難。
這個用于孕婦止吐的藥物在上個世紀中旬猶如惡魔一般,摧殘了數以萬計的胎兒,全球范圍內因此產生了1萬余例畸形“海豹兒”。
令人感嘆的是,事后一系列的意外發現和科學研究,又讓沙利度胺完成了從魔鬼到天使的華麗轉身。
沙利度胺不但促使了藥物監管的變革,還造就了著名的制藥公司Celgene和全球銷售排名前五的重磅炸彈藥物來那度胺。其致畸形機理曾經是科學界的一個謎,相關研究促進了免疫、抗炎、血管生成抑制劑、抗腫瘤藥物的發展。
發現沙利度胺有害成分只是分子中的一個手性異構體,引起人們對藥物中手性現象的重視,間接推動了手性技術的發展。沙利度胺還推動了當前炙手可熱的蛋白降解技術PROTAC的興起,可以說是為小分子藥物的未來打開了一扇門。
沙利度胺的救贖之路仍在繼續,從來沒有一個藥物有如此豐富多彩的故事,背后的那些人和事都值得我們好好回味。
1
災難源于
一個優秀藥物研發團隊的意外發現
關于沙利度胺(thalidomide)的發現,歷史上是有爭議的。
一說是瑞士制藥公司諾華的前身Ciba與納粹德國合作研究抗生素時第一次合成了沙利度胺。1962年反應停事件后,Ciba當時的研發副總裁專門在雜志《JAMA》上對這一說法進行了辟謠。
比較靠譜的說法是沙利度胺源于德國制藥公司Chemie Grünenthal(現在GmbH)的一個意外發現。
戰后的聯邦德國百廢待興,肥皂制造商Chemie Grünenthal決定進軍制藥界。1953年左右,他們聘請了Heinrich Mueckter,一個在德國部隊研究抗病毒藥物的科學家,擔任研發的負責人。
Mueckter的助手Wilhelm Kunz在合成抗生素藥物時分離到一個副產物。這個奇怪的化合物被做藥理的Herbert Keller注意到結構上類似于巴比妥類鎮靜劑格魯米特(圖1),經過后續的藥化和藥理研究,一個新的鎮靜劑沙利度胺誕生了(1)。
沙利度胺不但有鎮靜催眠作用,還能顯著抑制孕婦的妊娠嘔吐反應(2)。
此時,科學家們可能仍在為他們的意外發現而慶幸,殊不知一場人類的浩劫已悄然而至。
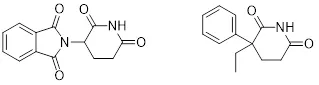
圖1:沙利度胺和格魯米特的化學結構
2
災難來勢兇猛
一時席卷全球
1957年10月,沙利度胺以商品名“反應停”正式投放市場。
基于簡單的動物實驗,制藥公司展開了鋪天蓋地的夸大宣傳,沙利度胺被描述成一個包治百病的“神奇藥物”。
特別是,沙利度胺確實能有效減輕孕婦的惡心、嘔吐、緊張和失眠等癥狀。沙利度胺的廣告稱其為沒有任何副作用的抗妊娠反應藥物。
不到一年的時間,沙利度胺就風靡全球46個國家,并成為非處方藥物,其銷量甚至可以媲美阿司匹林。至1959年,僅在聯邦德國就有超過l00萬人服用過該藥物。到1960年,人們注意到世界各地前所未有地出生了大量四肢缺損的先天性“海豹肢癥”嬰兒(圖2)。
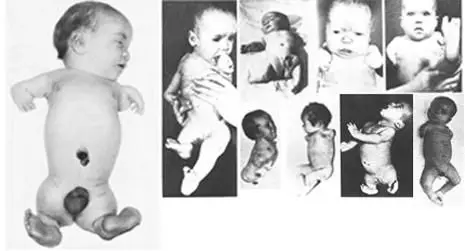
圖2:沙利度胺致殘的嬰兒
現在知道,這正是由于婦女在懷孕初期服用具有強烈致畸作用的藥物沙利度胺所造成的。
沙利度胺的第一個受害者是1956年出生的一名沒有耳朵的女嬰,那時藥品還未上市,女嬰的父親正是藥品生產商Chemie Grünenthal公司的員工,從內部渠道獲得了藥物樣品。
據統計,沙利度胺事故共造成全球兩千多名嬰兒死亡,超過一萬名嚴重殘疾,流產和輕微殘缺的并沒有計算在內。
這個事故是一個不折不扣的人間悲劇,其中有意外,但也有許多人為因素,包括科學家的不嚴謹、藥品生產商的虛假宣傳以及監管機構的草率等。事后只有部分受害者得到了賠償,有關官司持續至今。
Grünenthal公司在德國政府的庇護下,也沒有得到嚴厲的處罰。直至2012年,公司CEO在一個致殘嬰兒雕像揭幕儀式上,才正式向公眾道歉,已經整整遲到了50年之久。
3
災難的拯救
三個醫生成為最大英雄

第一個公開警告沙利度胺致畸作用的是一個叫William McBride的澳大利亞產科醫生。他在1961年向權威醫學雜志《JAMA》寫信報告了他們醫院4例海豹胎嬰兒,母親均有服用沙利度胺的歷史(3)。
與此同時,兒科醫生Widukind Lenz,當時是德國漢堡大學兒科的主任,也懷疑到沙利度胺和海豹胎流行的關系,并展開了一些科學研究。1962年,也是在《JAMA》雜志,他向全世界發出了沙利度胺致畸的警告(4)。
起初,制藥公司對于這些警告保持了沉默,直到媒體公開報道后,迫于壓力,沙利度胺在各個國家陸續撤市。
McBride和Lenz醫生無疑成為拯救這次災難的英雄。而此后兩人的人生軌跡卻截然不同。Lenz本來就是知名科學家,后來繼續研究沙利度胺和生育缺陷,成為一代大家,許多罕見的缺陷都是以他的名字命名的。
說個題外話,他的父親也是遺傳學家,就是臭名昭著的納粹德國種族優化的理論之父Fritz Lenz,而他的哥哥是提出theorem of Lenz理論的大數學家Hanfried Lenz。
McBride的人生就有點戲劇化了。1962年他第一個揭露沙利度胺悲劇后,被評為當年的年度人物,此后收到了無數的榮譽和獎勵。1971年他在悉尼創建了專門研究出生缺陷的研究所Foundation 41,并親自擔任所長。
可能是太渴望復制沙利度胺的成功案例,他又盯上了另外一個治療妊娠反應的藥物雙環胺(Debendox),宣稱這個藥物也有致畸作用。
1980年11月,McBride將他不太靠譜的研究成果投到《Toxicology and Applied Pharmacology》,被拒了,于是他編造修改數據后將文章改投到另一家國際雜志,仍遭拒絕。最后,他只好將造假文章發表在一個不知名的澳大利亞本地雜志上。
這篇文章的共同作者,也是他的助手,在文章發表后發現修改了數據,感到十分不安,于是將他告發了。
經歷了數年的調查,這件事碰巧被澳大利亞廣播電臺的記者得知,公之于眾,引發輿論壓力,McBride受到嚴厲處罰,身敗名裂,并被吊銷了醫生執照。
有意思的是,這名記者還挖掘出,當年第一個發現沙利度胺致畸作用的人,其實是醫院負責接生的一名護士(midwife), McBride只是搶了別人的功勞寫了一封信而已。
不管這件事的真假如何,McBride的人品肯定是有問題,絕不是一個好的科學家。這位老兄吊銷醫生執照后也不甘寂寞,1994年他又向英國醫學權威雜志《BMJ》寫信,宣稱沙利度胺不但致畸,還可能致突變。他的依據是兩個海豹胎患者生下后代,又是海豹胎(5)。
這著實將大家嚇了一跳,因為這意味著沙利度胺致殘是可遺傳的,將會持續影響數代人。好在隨后的科學研究發現這是McBride想多了。
詭異的是,正是McBride的這篇胡思亂想的文章,最終導致了多年后沙利度胺致殘機理的全面揭示。個中緣由,我們在后面還會提到。
說到英雄,不能漏掉當時拒絕批準沙利度胺在美國上市的FDA工作人員Frances Kelsey醫生。
1960年,美國Merrell公司獲得了沙利度胺美國銷售權,向FDA申請上市。當時才加入FDA三個月的Kelsey醫生負責醫學審查。她注意到沙利度胺對人有很好的催眠作用,但在老鼠實驗中效果卻很差,這是否意味著該藥物有種屬差異呢?而大部分安全性試驗來自動物,是否可靠?另外,她還注意到沙利度胺有外周神經炎的副作用,引起手指刺痛。
基于這些觀察和判斷,她斷然拒絕了沙利度胺的上市申請。后來FDA解密資料顯示,Merrell公司鍥而不舍,先后6次向FDA申請上市,全部遭到Kelsey醫生的拒絕,作為一個新人,她承受了巨大的壓力。
1962年沙利度胺事件揭露后,Kelsey醫生成為美國英雄,肯尼迪總統為其頒發了杰出公民服務獎章。
4
時隔近60年后
科學家才真正解開沙利度胺致畸的謎團
沙利度胺出事后,其致畸機理的研究成為熱點。過去半個世紀,前前后后大概有30多種假說,其中比較靠譜有調節免疫、誘導自由基和血管生成抑制劑等理論。沙利度胺真正作用的靶點也是眾說紛紜,從DNA、微管蛋白、離子通道到炎癥因子等等。但這些研究都不能很好地解釋為什么沙利度胺特異性導致海豹胎以及種屬差異的現象。
感謝小分子靶點鑒定技術的發展,日本科學家用表面帶有沙利度胺類似物的磁珠在細胞提取物中釣到了其主要分子靶點Cereblon (CRBN),2010年這一關鍵發現發表在《Science》上(6)。
CRBN是體內蛋白質降解機器E3泛素連接酶復合物的一部分。文章進一步顯示抑制CRBN影響動物四肢的發育,具體機制不太明朗。找到靶點后,沙利度胺之前眾多藥理功能的背后機制逐漸被揭示。原來沙利度胺就像分子膠水一樣,可以將E3泛素連接酶與各種底物粘在一起。這些蛋白靠近E3復合物后被泛素化標記,而后被溶酶體識別降解。
從2010年起,先后發現沙利度胺及其類似物通過CRBN降解鋅指蛋白轉錄因子Ikaros、Aiolos以及CK1a、ZFP91 and GSPT1等等,這些研究很好地解釋了其免疫抑制、抗腫瘤等作用。
至此,如果仔細去讀沙利度胺的歷史文獻,其致畸機理應該呼之欲出了。
這時,我們又要提到拯救沙利度胺災難的英雄McBride了。之前說到,他1994年向《BMJ》寫信懷疑沙利度胺致畸是可以遺傳的,因為兩個海豹胎患者的后代也是海豹胎。
他的這封信干系很大,當時沙利度胺老藥新用的研究正在興起。其實海豹胎的缺陷不是有了沙利度胺才發現的,百年前就觀察到了,可由人體罕見變異造成,包括Holt-Oram和Okihiro Syndrome兩種形式。
2002年,英國科學家發現McBride給《BMJ》信件中提到的一個海豹胎父親其實是Okihiro病人,并鑒定變異的基因是鋅指蛋白轉錄因子Sall4(7)。難道是因為沙利度胺造成了Sall4變異?
2004年,哈佛大學麻省總醫院的Lewis Holmes公開發表評論認為不太可能(8)。因為,一個男性尚在胎兒期間,暴露于有害化學物質而在精子中特異性產生表型可遺傳的基因變異,幾乎不可能。他又分析了64例沙利度胺受害者的后代,沒有發現任何不正常。McBride報告的案例可能是先天攜帶Sall4變異,碰巧其母親懷孕期間使用了沙利度胺。
無論是McBride,發現Sall4的英國科學家,還是Holmes,當時都忽略了一個今天看起來是如此明顯的可能性,那就是沙利度胺也許靶向Sall4,表型復制了Sall4變異。
令人不解的是,即使2010年沙利度胺被發現作用于CRBN而可以降解轉錄因子,仍然等待了8年之久,科學家才發現Sall4與沙利度胺的關聯,從而徹底解開了沙利度胺致畸之謎(圖3)。
2018年8月和10月,哈佛大學和Celgene的科學家分別在《Elife》和自然子刊《NCB》發表文章證實了沙利度胺降解Sall4而導致海豹胎(9,10)。而且因為細微的差別,沙利度胺在不同的動物中作用有差異,對老鼠中的Sall4不太敏感。老鼠是最常見的試驗動物,這也許是這一謎底姍姍來遲的原因之一。
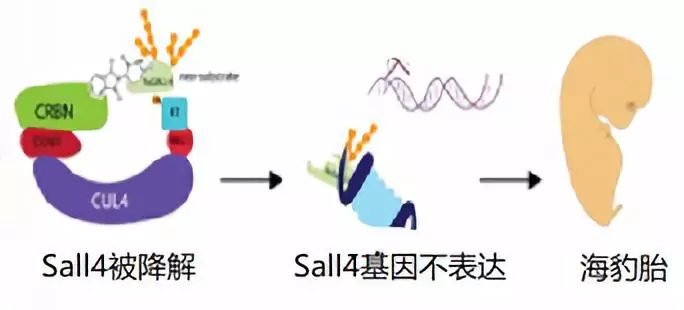
圖3:沙利度胺致畸機制
5
又是一個意外
沙利度胺踏上了長達半個世紀的救贖之路
1964年,以色列醫生Jacob Sheskin收治了一名麻風病人,伴有嚴重的結節性紅斑。病人非常痛苦,不能行動,徹夜難眠。
當時,沙利度胺被禁已有兩年,人們的恐懼之心漸淡。Jacob嘗試使用沙利度胺作為病人的安眠藥。
令人意外的是,這名病人服用沙利度胺后,不但睡了個好覺,醒來后病情大為減輕,甚至可以起床自由活動。
很快,在WHO的支持下,沙利度胺用于麻風病的臨床試驗展開,1965年即重新上市。
然而,由于風險管理不當,世界各地仍出現不少海豹胎事故。有數據顯示,2005到2010年,在巴西出現了100例以上由于沙利度胺使用不當造成的致殘嬰兒。
因此,當1998年沙利度胺在美國被批準上市時,FDA要求Celgene公司制定了一個嚴格的風險管理計劃:所有的病人必須登記,提供使用培訓,女性要求周期性懷孕檢查。
塞翁失馬,焉知非福。正是這個看似麻煩的風險管理計劃成就了Celgene。沙利度胺是一個沒有專利的老藥,但這套風險管理系統被Celgene申請了專利保護,因此免遭了仿制藥的沖擊。
過去幾十年,除麻風病外,沙利度胺還曾用于多種其它適應癥,包括抗感染、腸道紊亂、抗排斥、關節炎、MS、HIV惡質病等,但最后大放異彩的還是在腫瘤領域。
其實很早就有人嘗試用沙利度胺治療腫瘤,甚至做了一些零星的臨床試驗,但沒有引起人們重視。
后來,沙利度胺類藥物成為治療多發性骨髓瘤(MM)的重磅炸彈,也有點歪打正著的味道。
這還得感謝腫瘤領域里赫赫有名的一個人物,他就是提出腫瘤血管生成理論的哈佛醫學院教授Judah Folkman。通過抑制血管生成餓死癌細胞的理論,就像現在的免疫療法一樣,當時也是風光無限。
Folkman于1971年在《NEJM》雜志上發表文章提出實體瘤生長依賴于血管生成。1993年進一步提出血液瘤同樣如此,并宣稱找到了血管生成的生物標記物。1994年他實驗室的成員Robert Amato發現沙利度胺是有效的血管生成抑制劑(11)。
正在此時,一個婦女給Folkman打電話詢問血管生成抑制劑,看是否可以挽救她身患晚期多發性骨髓瘤而瀕臨死亡的丈夫。Folkman說服了這名患者的醫生使用沙利度胺,結果效果很好,隨后開展了相關臨床研究,有三分之一的無藥可救的晚期患者產生了應答(12)。
Celgene在此期間,又相繼開發了來那度胺(lenalidomide)和帕馬度胺(pomalidomide)兩個副作用更小的類似物。其中,來那度胺成為年銷售超過70億美元的超級重磅炸彈。
其實,這些藥物的作用機理與血管生成的關系不大,主要是免疫抑制和轉錄因子的降解,這就是制藥領域常見的歪打正著。
沙利度胺不久又賜給Celgene另外一個意外收獲。沙利度胺具有抑制TNFα的活性,在結構改造時,Celgene發現了活性更好的化合物阿普斯特(apremilast),這個藥物最終被FDA批準上市用于治療牛皮癬。
其實,阿普斯特是一個經典的PDE4抑制劑,作用機理與沙利度胺沒有半毛錢的關系。沙利度胺顯然成了一座取之不竭的金礦,Celgene挖掘的步伐并沒有停止,仍在繼續開發新的類似物,最新的肝癌藥物avadomide已經進入臨床研究(圖4)。
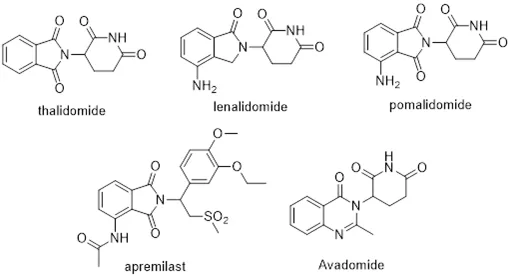
圖4:Celgene開發的沙利度胺及其類似物
沙利度胺的救贖之路,并不只是出了幾個好藥,成就了一家公司。
反應停事件至少從兩方面對藥物發現產生了深刻的影響。
一個是有關藥理,種屬差異得到重視,監管機構從此改變了藥理測試和安全性評價的要求,前面提到的美國FDA的Kelsey醫生在這方面做了很多工作。
另一個是有關化學,藥物中的手性現象到重視。不同的手性異構體其功能可能完全不同。沙利度胺分子有一個手性中心,后來發現只有S構型才有致畸作用(圖5)。
發現這一點也是頗費周折。1967年,美國科學家在《Nature》上發了一篇文章,他們不對稱合成了沙利度胺兩個異構體,在動物上發現致畸作用沒有差別(13)。直到1979年,德國科學家手性分離了兩個異構體,動物上發現只有S構型致畸(14)。
這就奇怪了,合成和分離兩種方法得到的化合物不應該有差別。后來的PK研究才發現,原來在體內無害的R構型可以慢慢轉變成有害的S構型。美國人做動物試驗時是口服給藥,而德國人是注射給藥,體內轉化的程度不一樣。
由于反應停事件的高曝光率,這個發現成為手性研究最喜歡引用的經典案例,也推動了手性藥物的發展。老藥的手性拆分,一度就像現在的氘代藥物一樣,成了開發新藥的撿漏捷徑。手性藥物的發展又間接促進了不對稱合成等手性技術的發展,某種程度上,沙利度胺功不可沒。
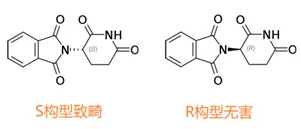
圖5:沙利度胺的兩個手性異構體
沙利度胺就像一個浪子回頭金不換的有志青年,并不滿足這些成就,他還想引領未來。
這就要說到當前生物醫藥領域里炙手可熱的小分子新技術PROTAC了。PROTAC是英文Proteolysis Targeting Chimera的縮寫,從字面上理解,就是靶向蛋白降解的小分子聯合體。
2001年,耶魯大學的Craig Crews在一篇《PNAS》文章中最早提出了這一概念(15)。他們設計的PROTAC分子一頭與目標蛋白結合,另一頭與E3泛素連接酶結合,目標蛋白靠近E3復合物后被泛素化(Ub)標記而降解。
聽起來熟悉?沒錯,這與2010年日本科學家發現的沙利度胺分子膠水的工作原理完全一致。也就是說沙利度胺其實是一個無意中被發現的最簡單的PROTAC分子。
PROTAC這項技術2001年被提出后,由于各種技術障礙,進展十分緩慢。直到2015年,諾華的研發負責人James Bradner,當時是哈佛的教授,在《Science》上發表新一代基于沙利度胺類似物的PROTAC分子,引爆了整個領域(16)。
PROTAC分子有別于傳統小分子藥物,通過蛋白降解,可以靶向難以成藥的靶點,甚至克服耐藥性等難題,因此迅速成為風投、制藥公司和學術界的新寵。目前,進展最快的PROTAC分子已經進入臨床研究,能否開創小分子藥物的未來,我們拭目以待。
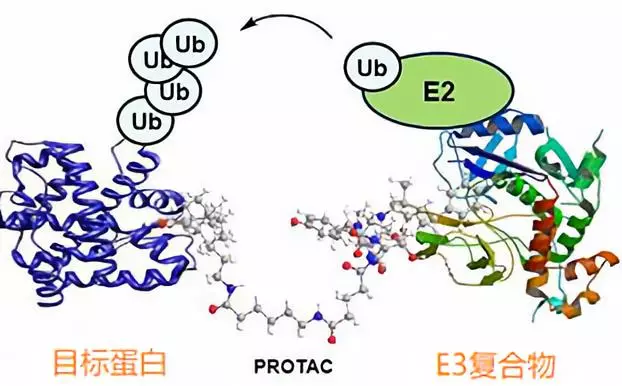
圖6:PROTAC工作原理
沙利度胺還會給人們帶來驚喜嗎?答案是肯定的。
就在兩周前,《Science》發表哈佛大學科學家最新的研究成果(17)。他們發現沙利度胺類化合物通過結合C2H2鋅指蛋白域(ZF domain)誘導蛋白降解。人類基因表達800多個C2H2-ZF蛋白域,哈佛大學的研究提供了證據,這些蛋白都有可能成為沙利度胺類似物的新靶點。
當然,免疫療法火熱的今天,人們不會忽視沙利度胺類藥物的免疫調節功能,他們與PD-1等免疫藥物的聯用也是熱門研究方向,也許不遠的將來還有好消息。
6
結語
這兩年,國內掀起了一股新藥研發的浪潮。讓我們所有做藥人以沙利度胺為鑒:一個未經考驗的新藥可以是魔鬼,也可以是天使,就看背后是謊言和貪婪,還是科學和良知。


